Prof. Domenico D'Ugo
Chirurgia Oncologica D'Avanguardia
domenico.dugo@policlinicogemelli.it
Segreteria
(+39) 06 3015 4511
domenico.dugo@policlinicogemelli.it
(+39) 06 3015 4511
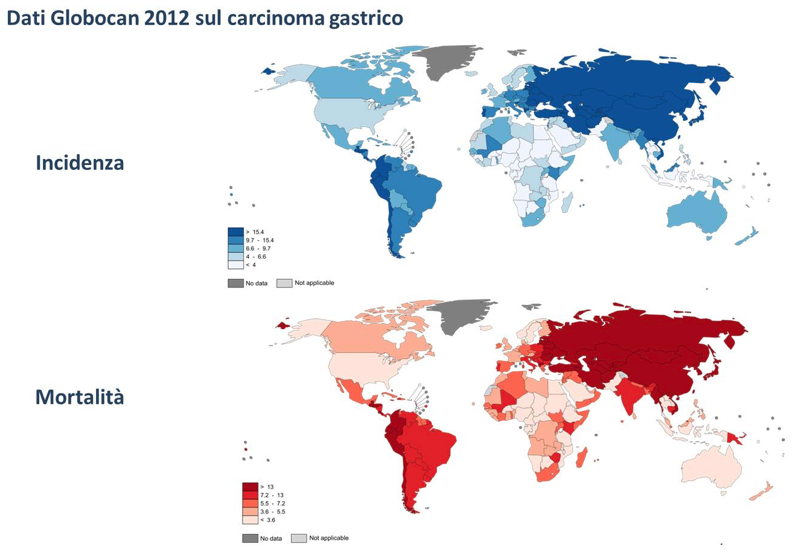
Il cancro gastrico (CG), ad oggi, rappresenta la quarta neoplasia per incidenza e la seconda causa di morte correlata a cancro nel mondo, con più di 930.000 nuovi casi e 700.000 morti all’ anno [Globocan 2012]. L’incidenza del CG, nel mondo, varia considerevolmente con livelli massimi in Giappone, Cina e Russia, e minimi livelli in Australia e America del Nord. L’incidenza di tale neoplasia è in diminuzione nei paesi a maggior livello socio- economico e nelle popolazioni che consumano maggiori quantità di frutta e verdure. L’Italia si colloca in una fascia intermedia con un’incidenza annuale di circa 38 nuovi casi/100000 abitanti/anno per i maschi e 25 nuovi casi/100000 abitanti/anno per le donne. L’incidenza maggioresi riscontra nelle regioni del centro-settentrione quali la Lombardia, la Toscana, il Lazio, il Friuli ed infine l’ Emilia Romagna.
a. Età. L’incidenza del cancro dello stomaco aumenta in modo progressivo con l’età; si passa ad un tasso di incidenza dell’1.5 casi su 100000/anno a 30 anni ai 40 casi/100000/anno nella fascia di età fra 45 e 64 anni.
b. Sesso. Il rischio, nel sesso maschile è 2.2 volte superiore al rischio nel sesso femminile con ampie differenze a seconda delle diverse aree geografiche.
c. Dieta. Cibi affumicati, salati o conservati aumentano il rischio di cancro allo stomaco, probabilmente a causa degli addotti al DNA indotti dai nitriti. Cibi freschi e ricchi di vitamine, soprattutto la vitamina C e la vitamina E, sembrerebbe svolgano un ruolo protettivo, così come alimenti ricchi di antiossidanti (polifenoli). Abitudini di vita.
d. Fumo e consumo di alcol aumentano il rischio, attraverso una prolungata irritazione della mucosa gastrica.
e. Obesità e reflusso gastroesofageo. Il rischio è aumentato in particolar modo nelle localizzazioni cardiali, a seguito delle trasformazioni della mucosa inizialmente determinate da esofagite.
f. Patologia gastrica associata. Alcune patologie croniche dello stomaco sono correlate ad un rischio neoplastico maggiore. La gastrite atrofica, a lungo termine induce metaplasia intestinale, diventando molto sensibile agli insulti sia endogeni che esogeni. I polipi adenomatosi e i polipi iperplastici, tipici della sindrome di Menetrier, possono degenerare in carcinoma. La gastroresezione espone il moncone residuo a un aumentato rischio di neoplasia, per l’insulto prolungato da parte degli acidi biliari e dei succhi pancreatici.
g. Helicobacter Pylori (HP). Questo batterio viene considerato il primo responsabile di una sequenza di trasformazioni della mucosa (gastrite atrofica-metaplasia intestinale-displasia-cancro) cui contribuirebbero la risposta infiammatoria all’infezione, la trasformazione da parte dei batteri dei nitrati in nitriti, la produzione di radicali liberi e l’inibizione della sintesi endogena di vitamina C.
Nell’eziologia del cancro gastrico sono noti diversi fattori di rischio, tra i quali si annoverano:
Il 90% circa dei tumori maligni dello stomaco è rappresentato, istologicamente, dall’adenocarcinoma. I linfomi, complessivamente, non superano il 5%, mentre, sarcomi, endoteliomi gastrici ed i carcinoidi rappresentano una rarità. Sebbene i carcinomi gastrici possano originare in qualsiasi area dello stomaco, anche in multi-focalità, le sedi più frequenti di carcinogenesi risultano essere l’antro ed il piloro (50-60%). La piccola e la grande curva sono interessate in minore frequenza. La localizzazione prediletta è pertanto la piccola curva in sede antro-pilorica. Istologicamente tutti i carcinomi gastrici sono composti fondamentalmente da 2 tipi di cellule: metaplastiche intestinali muco-secernenti e cellule mucose gastriche; talora si repertano forme miste. Le cellule di tipo intestinale contengono in sede apicale ampi vacuoli di muco ed orletti a spazzola con numerosi microvilli che rivestono spesso la loro superficie rivolta verso il lume. Le cellule mucose gastriche hanno le caratteristiche microscopiche di quelle della superficie mucosa delle fossette gastriche. Nei carcinomi ben differenziati questi 2 tipi cellulari sono facilmente evidenziabili, ma con la perdita della differenziazione e la progressiva anaplasia, si perdono gli aspetti caratteristici delle cellule.

a. Early Gastric Cancer (EGC). Questo tipo di cancro gastrico va distinto dal cancro avanzato per una miglior prognosi, con una sopravvivenza dopo l’intervento che, come riporta la letteratura, specie quella giapponese, può raggiungere il 90% a cinque anni. Istologicamente l’EGC è definito come un carcinoma con invasione limitata o alla mucosa (Tipo M) o alla sottomucosa (Tipo SM) della parete gastrica. Queste lesioni possono essere protrudenti (Tipo 1), superficiali (Tipo 2), escavate (Tipo 3). Il tipo 2 può essere suddiviso nei sottotipi, rilevato (Tipo 2 A), piatto (Tipo 2 B), depresso (Tipo 2 C). All’EGC possono corrispondere due tipi di tumore, una forma che è dal punto di vista biologico relativamente stabile ed una che mostra una precoce invasione della parete gastrica in profondità.
b. Adenocarcinoma gastrico avanzato. Quest’ultimo può essere classificato attraverso la classificazione di Borrmann, dell’OMS, di Lauren, con quella di Ming ovvero con il sistema TNM.
b.1 Classificazione di Borrmann.
È una classificazione del cancro avanzato che ha tuttora valore per chirurghi, radiologi ed endoscopisti; suddivide microscopicamente il cancro gastrico in 4 tipi:
b1.1 Tumore vegetante nel lume gastrico con aspetto nodulare, a cavolfiore o a fungo; possono essere ulcerati in superficie.
b1.2 Tumore ulcerato con bordi elevati e margini distinti, non infiltranti.
b1.3 Tumore escavato con bordi indistinti e margini infiltranti, con possibili ulcerazioni focali.
b1.4 Tumore infiltrante diffuso, senza ulcerazioni.
I tipi 1 e 2 hanno cellule differenziate, con strutture ghiandolari; i tipi 3 e 4 possiedono cellule meno differenziate, incapaci di dare origine a strutture ghiandolari. Questi tumori a crescita infiltrativa possono rappresentare il tipico quadro di “linite plastica.”
b.2 Classificazione istologica dell’OMS (1977). Descrive cinque principali tipi di carcinoma gastrico, fondandosi sulle caratteristiche citologiche ed architetturali; non tiene però conto dell’istogenesi e dei requisiti clinici del tumore:
b2.1 Tubulare
b2.2 Papillare
b2.3 Mucinoso
b2.4 Anello con castone
b2.5 Indifferenziato
b.3 Classificazione di Lauren (1965). Distingue due varietà, “intestinale” e “diffuso”. La varietà intestinale presenta la struttura di un adenocarcinoma tubulare o papillare ben differenziato; è spesso associato ad estesa metaplasia intestinale della mucosa gastrica, insorge perlopiù in pazienti con età avanzata, di sesso maschile e nei paesi ad elevata incidenza, essendo probabilmente maggiormente legato a fattori carcinogenetici ambientali. La varietà diffusa è costituita da cellule indipendenti muco-secernenti o “ad anello con castone”; cresce infiltrando diffusamente la parete gastrica, è più frequente in pazienti giovani, dà più frequentemente metastasi peritoneali ed ha prognosi peggiore.
b.4 Classificazione di Ming. Questa classificazione analizza le modalità di accrescimento del tumore e distingue un tipo a crescita “espansiva” ed uno a crescita “infiltrativa”. Il tipo espansivo ha crescita coesiva con formazione di noduli o masse di elementi ghiandolari, mentre il tipo infiltrativo invade rapidamente e diffusamente il tessuto circostante. Il tipo espansivo è più frequente, il tipo infiltrativo è correlabile al tipo diffuso di Lauren ed è a prognosi peggiore. E’ possibile classificare il tumore secondo Ming solo tramite l’esame del pezzo operatorio.
b.5 Classificazione TNM. Il sistema TNM codifica l’estensione del tumore primitivo (T), l’interessamento dei linfonodi locoregionali (N) e la presenza di metastasi a distanza (M) e fornisce, sulla base di questi parametri anatomici, la definizione dello stadio. Lo stadio può essere definito in diversi momenti della malattia, potendosi, infatti, distinguere una stadi azione clinica pre-trattamento ed una post trattamento. La classificazione clinica pre-trattamento, indicata come cTNM, si basa sugli elementi che possono essere valutati prima del trattamento chirurgico (esame obiettivo, esami strumentali di imaging, endoscopia, biopsie ed esami di laboratorio). La classificazione patologica, secondo la VII edizione del sistema TNM messa appunto nel 2010 dall’AJCC (American Joint Committee on Cancer) e UICC (Union International Contre le Cancer), per i tumori dello stomaco è la seguente:

Tx: non si riesce a classificare il tumore primitivo.
T0: non si rileva il tumore primitivo.
Tis: carcinoma in situ senza invasione della lamina propria.
T1: invade la lamina propria e arriva alla sottomucosa.
T2: invade la tonaca muscolare senza intaccare la sierosa.
T3: intacca la sierosa senza invadere strutture adiacenti.
T4: invade strutture adiacenti.
N (metastasi linfonodali)
Nx: metastasi linfonodali non rilevabili.
N0: metastasi linfonodali assenti.
N1: da 1 a 6 linfonodi regionali sede di metastasi
N2: da 7 a 15 linfonodi regionali sede di metastasi.
N3: oltre 15 linfonodi sede di metastasi.
M (metastasi a distanza)
Mx: metastasi non rilevabili.
M0: metastasi assenti.
M1: presenza di metastasi a distanza.
Gli stadi ottenibili con questi dati sono (zero e 1A corrispondono all’early gastric cancer)
Stadio 0: TisN0M0
Stadio 1A: T1N0M0
Stadio 1B: T2N0M0
Stadio 2: T1N2M0, T2N1M0, T3N0M0
Stadio 3A: T2N2M0, T3N1M0, T4N0M0
Stadio 3B: T3N2M06
Stadio 4: T4N(da 1 a 3)M0, T(da 1 a 3)N3M0, T e N(qualunque)M1
Il carcinoma gastrico, può esser analizzato secondo aspetti macroscopici , istogenetici e in base al tipo di infiltrazione e di estensione.
a. Early Gastric Cancer (EGC). Questo tipo di cancro gastrico va distinto dal cancro avanzato per una miglior prognosi, con una sopravvivenza dopo l’intervento che, come riporta la letteratura, specie quella giapponese, può raggiungere il 90% a cinque anni. Istologicamente l’EGC è definito come un carcinoma con invasione limitata o alla mucosa (Tipo M) o alla sottomucosa (Tipo SM) della parete gastrica. Queste lesioni possono essere protrudenti (Tipo 1), superficiali (Tipo 2), escavate (Tipo 3). Il tipo 2 può essere suddiviso nei sottotipi, rilevato (Tipo 2 A), piatto (Tipo 2 B), depresso (Tipo 2 C). All’EGC possono corrispondere due tipi di tumore, una forma che è dal punto di vista biologico relativamente stabile ed una che mostra una precoce invasione della parete gastrica in profondità.
b. Adenocarcinoma gastrico avanzato. Quest’ultimo può essere classificato attraverso la classificazione di Borrmann, dell’OMS, di Lauren, con quella di Ming ovvero con il sistema TNM.
b.1 Classificazione di Borrmann. E’ una classificazione del cancro avanzato che ha tuttora valore per chirurghi, radiologi , ed endoscopisti; suddivide microscopicamente il cancro gastrico in 4 tipi:
b1.1 Tumore vegetante nel lume gastrico con aspetto nodulare, a cavolfiore o a fungo; possono essere ulcerati in superficie.
b1.2 Tumore ulcerato con bordi elevati e margini distinti, non infiltranti.
b1.3 Tumore escavato con bordi indistinti e margini infiltranti, con possibili ulcerazioni focali.
b1.4 Tumore infiltrante diffuso, senza ulcerazioni
I tipi 1 e 2 hanno cellule differenziate, con strutture ghiandolari; i tipi 3 e 4 possiedono cellule meno differenziate, incapaci di dare origine a strutture ghiandolari. Questi tumori a crescita infiltrativa possono rappresentare il tipico quadro di “linite plastica.”
b.2 Classificazione istologica dell’OMS (1977). Descrive cinque principali tipi di carcinoma gastrico, fondandosi sulle caratteristiche citologiche ed architetturali; non tiene però conto dell’istogenesi e dei requisiti clinici del tumore:
b2.1 Tubulare
b2.2 Papillare
b2.3 Mucinoso
b2.4 Anello con castone
b2.5 Indifferenziato
b.3 Classificazione di Lauren (1965). Distingue due varietà, “intestinale” e “diffuso”. La varietà intestinale presenta la struttura di un adenocarcinoma tubulare o papillare ben differenziato; è spesso associato ad estesa metaplasia intestinale della mucosa gastrica, insorge perlopiù in pazienti con età avanzata, di sesso maschile e nei paesi ad elevata incidenza, essendo probabilmente maggiormente legato a fattori carcinogenetici ambientali. La varietà diffusa è costituita da cellule indipendenti muco-secernenti o “ad anello con castone”; cresce infiltrando diffusamente la parete gastrica, è più frequente in pazienti giovani, dà più frequentemente metastasi peritoneali ed ha prognosi peggiore.
b.4 Classificazione di Ming. Questa classificazione analizza le modalità di accrescimento del tumore e distingue un tipo a crescita “espansiva” ed uno a crescita “infiltrativa”. Il tipo espansivo ha crescita coesiva con formazione di noduli o masse di elementi ghiandolari, mentre il tipo infiltrativo invade rapidamente e diffusamente il tessuto circostante. Il tipo espansivo è più frequente, il tipo infiltrativo è correlabile al tipo diffuso di Lauren ed è a prognosi peggiore. E’ possibile classificare il tumore secondo Ming solo tramite l’esame del pezzo operatorio.
b.5 Classificazione TNM. Il sistema TNM codifica l’estensione del tumore primitivo (T), l’interessamento dei linfonodi locoregionali (N) e la presenza di metastasi a distanza (M) e fornisce, sulla base di questi parametri anatomici, la definizione dello stadio. Lo stadio può essere definito in diversi momenti della malattia, potendosi, infatti, distinguere una stadi azione clinica pre-trattamento ed una post trattamento. La classificazione clinica pre-trattamento, indicata come cTNM, si basa sugli elementi che possono essere valutati prima del trattamento chirurgico (esame obiettivo, esami strumentali di imaging, endoscopia, biopsie ed esami di laboratorio). La classificazione patologica, secondo la VII edizione del sistema TNM messa appunto nel 2010 dall’AJCC (American Joint Committee on Cancer) e UICC (Union International Contre le Cancer), per i tumori dello stomaco è la seguente:
T (estensione del tumore primitivo)
Tx: non si riesce a classificare il tumore primitivo.
T0: non si rileva il tumore primitivo.
Tis: carcinoma in situ senza invasione della lamina propria.
T1: invade la lamina propria e arriva alla sottomucosa.
T2: invade la tonaca muscolare senza intaccare la sierosa.
T3: intacca la sierosa senza invadere strutture adiacenti.
T4: invade strutture adiacenti.
N (metastasi linfonodali)
Nx: metastasi linfonodali non rilevabili.
N0: metastasi linfonodali assenti.
N1: da 1 a 6 linfonodi regionali sede di metastasi
N2: da 7 a 15 linfonodi regionali sede di metastasi.
N3: oltre 15 linfonodi sede di metastasi.
M (metastasi a distanza)
Mx: metastasi non rilevabili.
M0: metastasi assenti.
M1: presenza di metastasi a distanza.
Gli stadi ottenibili con questi dati sono (zero e 1A corrispondono all’early gastric cancer)
Stadio 0: TisN0M0
Stadio 1A: T1N0M0
Stadio 1B: T2N0M0
Stadio 2: T1N2M0, T2N1M0, T3N0M0
Stadio 3A: T2N2M0, T3N1M0, T4N0M0
Stadio 3B: T3N2M06
Stadio 4: T4N(da 1 a 3)M0, T(da 1 a 3)N3M0, T e N(qualunque)M1
La descrizione classica del paziente in stadio avanzato di emaciazione, con anemia vomito, tumore palpabile in sede epigastrica e metastasi riconoscibili all’esame diretto, appartiene ad un tempo in cui la diagnosi era inevitabilmente tardiva, e la chirurgia gastrica muoveva ancora i suoi primi passi. Basta ricordare l’importanza che veniva data al segno di Troisier, ossia alla dimostrazione di metastasi palpabili nella fossa sopraclaveare sinistra, dove il dotto toracico sfocia nell’angolo venoso.
I sintomi iniziali, che solitamente richiamano l’attenzione del paziente ma soprattutto dei suoi familiari, sono rappresentati da:
Talvolta l’insidiosa evoluzione di questi segni è bruscamente interrotta dalla comparsa di un saltuario vomito alimentare che in breve si aggrava fino a diventare quotidiano, se l’infiltrazione dell’antro raggiunge e irrigidisce il piloro.
Un sintomo che raramente si presenta all’inizio della malattia ma che spaventa il paziente e lo induce a visita è spesso l’ematemesi; mentre tardivo e incostante è il dolore che però, quando localizzato in sede epigastrica è di natura ancora incerta ma associato ai sintomi prima detti, deve destare il sospetto di neoplasia gastrica e promuovere l’immediato iter di accertamenti diagnostici. Per le lesioni del terzo inferiore dell’esofago e iuxtacardiali, inoltre, sono frequenti disfagia e dolori retrosternali; ma tali sintomi non sono sempre precoci perché la lesione può solo secondariamente infiltrare e restringere il cardias.
Le complicanze sono rappresentate da:
Ad oggi la diagnosi di cancro dello stomaco viene effettuata principalmente tramite indagini strumentali e di laboratorio.
Le indagini strumentali normalmente eseguite sono: l’ecografia, l’esame radiografico con pasto baritato e/o doppio contrasto, la TC, l’endoscopia e negli ultimi anni anche l’ecoendoscopia, e infine la laparoscopia.
1.Nat Rev Genet. 2004 Jul;5(7):522-31.MicroRNAs: small RNAs with a big role in gene regulation. He L1, Hannon GJ.
2. RNA. 2006 Sep; 12 MicroRNAs from the Planarian Schmidtea mediterranea: A model system for stem cell biology. Dasaradhi Palakodeti,1 Magda Smielewska,1 and Brenton R. Graveley.
3. Cell. 1993 Dec 3;75(5):843-54..The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Lee RC1, Feinbaum RL, Ambros V.
4. Ha et al., 1996; Wightman e tal.
5. P. Del Rio et al. – Ann. Ital. Chir., 2013 Advanced stage gastric cancer and Neoadjuvant chemotherapy. Our experience in surgical respectability
Sabino De Placido et al. Core Curriculum, oncologia medica
6. Helicobacter and cancer collaborative group, 2001
7. Okamura K, Tsujitani S, Konìrenaga D, et al. Lymphadenctomy for cure in patients with early gastric cancer and lymphonode metastasis. Am J Surg; 155: 476-480, 1988
8. Rhode H, Kostner R, Gebbensleben B, Stutzer H, Rau E. Errors of surgical staging in patients with cancer of the stomach. Scand J Gastroenterol; 22 (33): 27-30, 1987